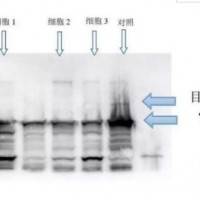
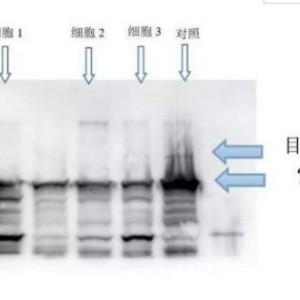
RIP 的基本原理
-
用抗体捕获细胞核内或细胞质中内源性的RNA结合蛋白。
-
免疫沉淀把RNA结合蛋白及其结合的RNA一起分离出来。
-
结合的RNA序列通过定量RT-PCR或高通量测序(RIP-Seq)方法来鉴定。
实验方法
01
蛋白A琼脂糖凝胶和抗体的固定
-
取被protein-A包裹的磁珠悬浮液,先用PBS洗涤,然后用NT2缓冲液洗涤磁珠两次。
-
将NT2缓冲液和BSA添加到磁珠悬浮液中,在室温下搅拌培养2小时。
-
将抗体添加到上述步骤得到的混合物中,然后在室温下孵育1小时。
-
用NT2缓冲液洗涤protein-A包被的磁珠,然后搅拌3min,1000g,离心1min,重复此过程5次。
02
细胞裂解物的制备
-
将细胞先转移至离心管,然后在4℃,1000g,离心10min;
-
细胞用预冷的PBS洗涤两次;
-
加入与细胞等体积的RIP裂解液重悬细胞,轻轻地吹打均匀于冰上静置5min;
-
每管分装400 μL细胞裂解液,于-80℃冰箱保存;
03
免疫沉淀反应
-
将上述步骤得到的细胞裂解液4 °C,14000 g,离心10 min;
-
取清液到一个新的离心管中,4 °C,14000 g,离心5 min,再将上清液再转移至另一个新的管子中;
-
在制备的上清液中加入10倍体积的NET-2buffer重悬的磁珠,吹打混匀;
-
取约10%的样品作为“Input”备份,−80 °C保存备用;
-
在裂解液中加入10倍体积的NET-2 buffer重悬的磁珠,作为阴性对照;
-
接着在4℃恒温搅拌下孵育12-16h;
-
孵育后,离心分离protein-A包被的磁珠,取出10%上清备份“output”;
-
用NT2缓冲液洗涤磁珠,将其重悬后并混合3min,然后4℃,1000 g离心,重复6次。
RNA的分离与分析
-
将Trizol加入到等体积的磁珠中,并将混合物重新悬浮,RNA立即被分离或冷冻在液氮中。
-
检测RNA的浓度和质量,并通过RT-PCR和测序鉴定RNA.
RIP实验中常见问题及解决办法
-
非特异性RNA的结合过高
在室温下搅拌培养2小时,可以减少mRNA与磁珠的非特异性相互作用。
-
分离得到的RNA水平过低
实验过程中需确保细胞中有足够水平的蛋白质。